TEORI ASAM BASA ARRHENIUS
PPT ASAM BASA PowerPoint Presentation, free download ID5640840
CH3COOH + NaCH3COO (dengan komposisi komponen buffernya adalah:. Maka kapasitas buffer yang dimiliki ini termasuk kecil. penambahan basa atau asam pada suatu larutan buffer memang dapat mengubah nilai pH-nya. Namun perubahan itu tidak begitu besar dan bisa diabaikan. Akan tetapi apabila jumlah asam maupun basa yang ditambahkan semakin banyak.
Indikator Asam Basa
TM dan laporan praktikum Kimia Dasar - materi buffer. Larutan penyangga atau sering disebut larutan buffer adalah larutan yang dapat mempertahankan pH pada kisarannya apabila terdapat upaya untuk menaikkan atau menurunkan pH, melalui penambahan air/asam/basa dalam jumlah yang besar. Larutan penyangga memiliki dua komponen yaitu asam dan basa.

Mengenal Asam Basa Sifat, Cara Membedakan, dan Klasifikasinya Kimia Kelas 11
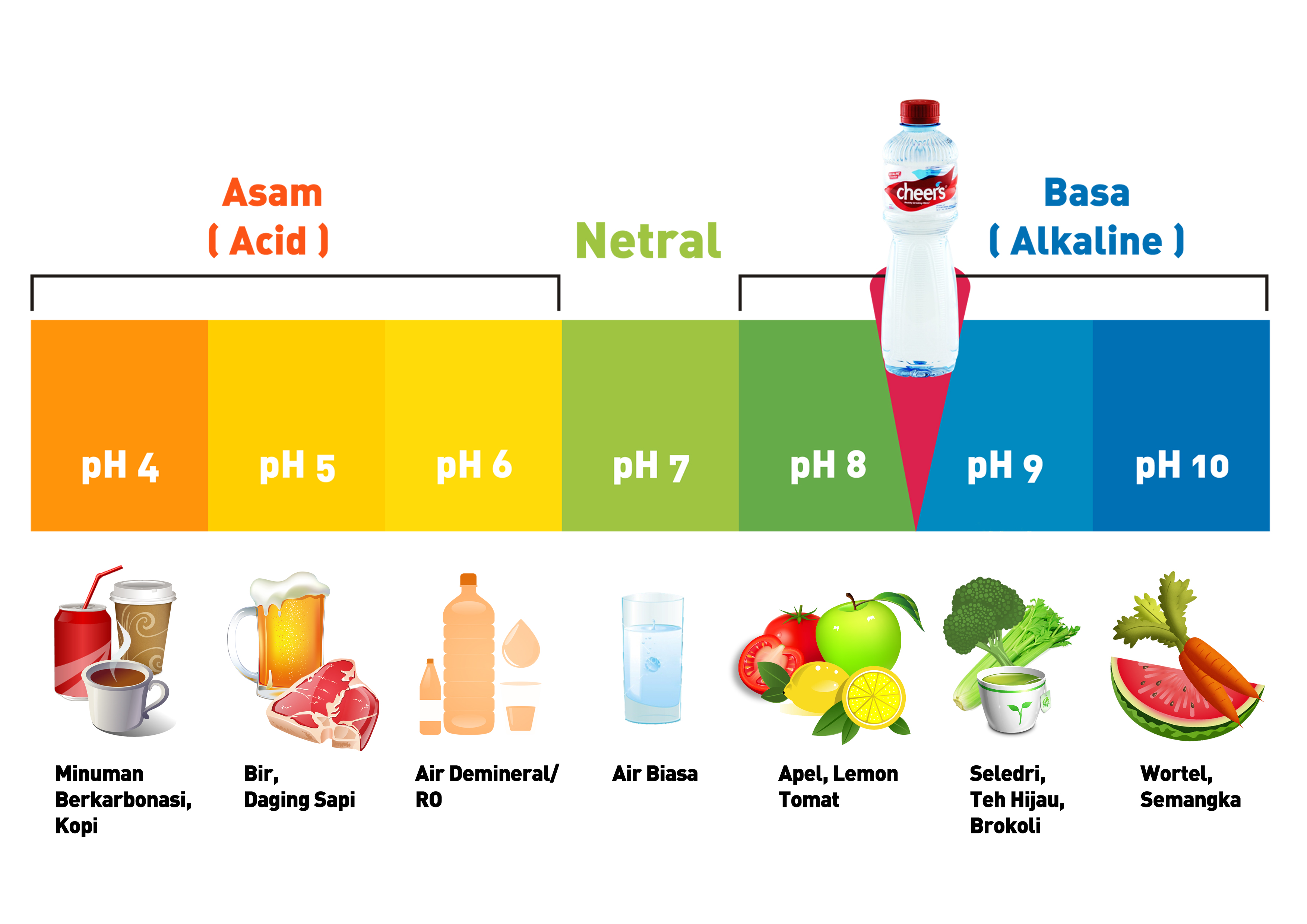
Di artikel Kimia kelas 11 ini, kita akan belajar mengenai macam-macam indikator asam basa dan cara menggunakannya. Yuk, baca sampai habis! -- Teman-teman, di artikel sebelumnya, kamu sudah mengenal apa itu zat asam-basa dan cara membedakannya, ya. Senyawa asam akan mengandung ion H+. Contohnya buah-buahan kaya vitamin C, cuka, minuman bersoda, dsb.

Contoh Soal menentukan pasangan asam basa konjugasi menurut BronstedLowry YouTube
Titrasi asam basa melibatkan reaksi antara asam dengan basa sehingga akan terjadi perubahan pH larutan yang dititrasi. Titrasi harus dilakukan hingga mencapai titik ekuivalen. Titik ekuivalen merupakan keadaan saat asam dan basa tepat habis bereaksi secara stoikiometri. Umumnya titik ekuivalen ditandai dengan perubahan warna dari indikator.

Pengertian Asam dan Basa Serta Penggunaannya
Penambahan sedikit asam atau basa ke dalam larutan penyangga atau pengenceran tidak mengubah pH larutan.. Pada larutan penyangga yng terdiri atas CH3COOH dengan NaCH3COO, asam asetat mengion sebagian menurut reaksi kesetimbangan, sedangkan natrium asetat mengion sempurna. Misalnya jumlah CH3COOh yang dilarutkan = a mol dan jumlah yang.

Uji Asam Basa Menggunakan Indikator Alami Praktikum Kimia Kelas 11 MIPA YouTube
Larutan garam yang berasal dari asam lemah dan basa kuat ini bersifat BASA. Sebagai contoh adalah NaCH3COO, garam ini terbentuk dari hasil reaksi netralisasi antara NaOH dan CH3COOH dan di dalam air terionisasi sempurna menghasilkan ion Na+ dan CH3COO-.. berasal dari asam lemah dan basa lemah ini dapat bersifat ASAM, BASA, atau NETRAL. Ini.

Bagaimana Cara Menentukan Larutan Asam Atau Basa My XXX Hot Girl
Asam dan basa dapat bereaksi menghasilkan air serta senyawa ionic garam. Reaksi itu disebut reaksi netralisasi. Asam dan basa merupakan dua jenis larutan yang kerap digunakan dalam kehidupan sehari-hari manusia. Asam dan basa ada yang memiliki sifat kuat dan juga lemah. Berikut daftar nama asam kuat, asam lemah, basa kuat, dan juga basa lemah:

Mengenal Asam Basa Sifat, Cara Membedakan, dan Klasifikasinya Kimia Kelas 11
Sebagaimana sifat larutan penyangga yang mampu menetralkan kelebihan asam atau basa yang ditambahkan, larutan buffer adalah larutan yang juga memiliki kemampuan untuk menjaga kestabilan pH dalam larutan.. (CH3COOH) dan natrium asetat (NaCH3COO). Jika diketahui pKa asam asetat adalah 4,76, hitung konsentrasi yang dibutuhkan untuk masing.
PPT ASAM DAN BASA PowerPoint Presentation, free download ID1244635
Cara Membedakan Asam dan Basa. Senyawa asam dapat dengan mudah ditemukan pada buah-buahan, seperti jeruk dan lemon. Selain itu, bisa juga ditemukan pada bahan makanan, seperti cuka. Bahkan, senyawa asam juga banyak digunakan sebagai bahan pengawet makanan lho, misalnya asam benzoat yang dimanfaatkan sebagai pengawet jus buah dan selai.

Cara Menentukan Senyawa Bersifat Asam Basa Atau Netral Digunakan
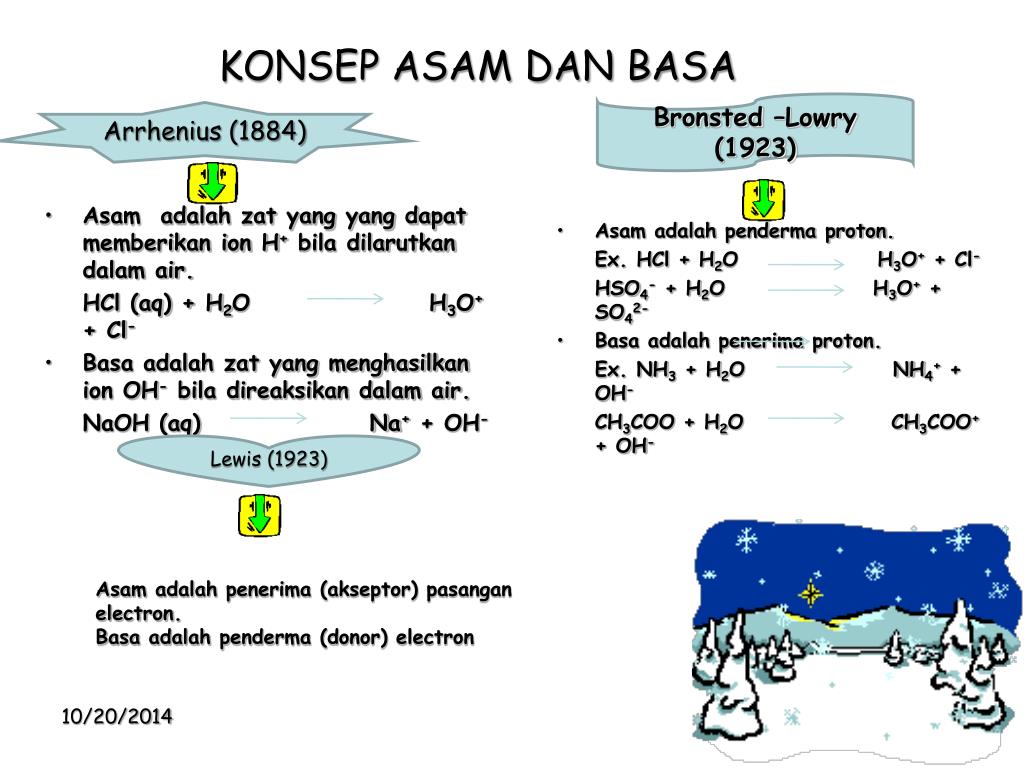
Menurut Arrhenius, asam adalah zat yang dalam air akan melepaskan ion H+. Basa adalah suatu senyawa yang jika dilarutkan dalam air (larutan) dapat melepaskan ion hidroksida (OH-). Oleh karena itu, semua rumus kimia basa umumnya mengandung gugus OH. Dalam keadaan murni, basa umumnya berupa kristal padat dan bersifat kaustik.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
NaCH3COO Termasuk garam BASA karena berasal dari basa kuat NaOH dan asam lemah CH3COOH. 2 NH4NO3 Termasuk garam ASAM karena berasal dari asam kuat HNO3 dan basa lemah NH4OH.. Carilah hal-hal yang berkaitan dengan proses biologi atau apa saja terkait bidang biologi yang berhubungan dengan ikatan kimia dan gaya antar molekul. 255. 0.0.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Jawaban: Untuk menentukan larutan penyangga adalah campuran antara asam atau basa lemah dengan asam atau basa konjugasinya (garam),. Jawaban: Di soal tersebut, CH3COOH merupakan asam lemah dan NaCH3COO adalah basa konjugasinya. Maka dari itu, larutan pada soal di atas termasuk larutan penyangga.

Contoh Asam Basa Menurut Bronsted Lowry Berbagai Contoh Riset
Garam adalah senyawa ionik yang terbentuk akibat reaksi netralisasi asam dan basa. Kebalikan reaksi netralisasi asam basa adalah hidrolisis garam. Hidrolisis berasal dari bahasa Yunani "hydro" yang berarti air dan "lysis" yang berarti lepas atau penguraian. Hidrolisis garam dapat diartikan sebagai reaksi reversible penguraian garam oleh.

Teori Asam Basa
Asam asetat murni sangat mudah terbakar, apalagi jika suhunya mencapai 39 °C. ADVERTISEMENT. CH3COOH mampu bereaksi dengan air dan menghasilkan ion etanoat dan ion hidroksonium. Namun, perlu digarisbawahi bahwa hanya sekitar 1% saja yang mampu bereaksi. Sedangkan sisanya tetap menjadi CH3COOH karena sifatnya yang reversibel.

PPT TEORI ASAM DAN BASA PowerPoint Presentation, free download ID3560268
Dokumen tersebut membahas tentang sifat larutan penyangga dan cara kerjanya dalam mempertahankan pH ketika ditambahkan asam, basa, atau pengencer. Larutan penyangga terdiri atas campuran asam/basa lemah dan garamnya.. Selanjutnya, larutan CH3COOH+NaCH3COO di gelas kimia 250 mL tersebut dituang masing-masing 10 mL ke dalam 3 gelas kimia.

Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah Berbagai Contoh
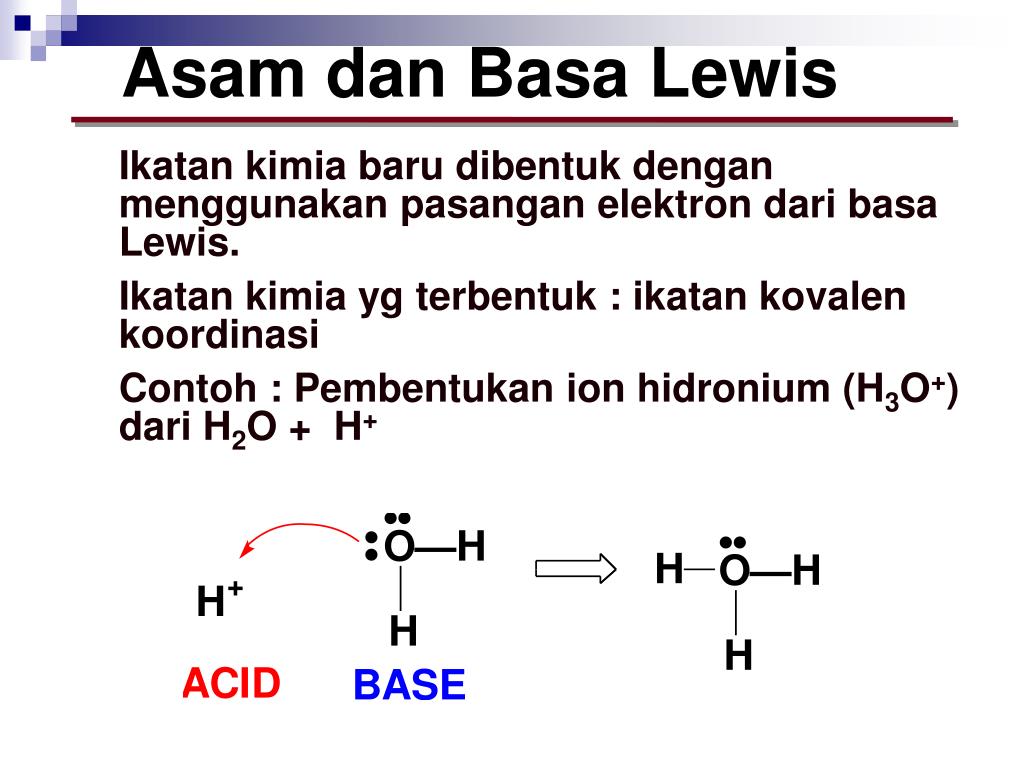
Basa = penerima H+. Reaksi kimia yang bisa dijadikan contoh berdasarkan teori Bronsted-Lowry misalnya pada asam klorida (HCL) dan air (H2O) berikut ini: HCl + H2O ⇌ H3O+ + Cl-. Penjelasannya seperti mengutip pada emodul Kemdikbud: HCL bersifat asam karena itu ia mendonorkan ion H+ nya kepada H20. H20 bersifat basa karena ia menerima donor H+.